收藏临床试验入门-中英文版
来源:高浓度臭氧检测仪 发布时间:2024-08-13 08:12:22分层是将患者分组的一种方法,当可能会影响干预成功的因素已知时,用于随机试验中。 这是罗氏高管发的一本小册子,这本书浅显易懂,但又专业十足。通俗易懂描述临床试验从发现,到筛选,到选择剂量,
服务热线:010-82912186
分层是将患者分组的一种方法,当可能会影响干预成功的因素已知时,用于随机试验中。
这是罗氏高管发的一本小册子,这本书浅显易懂,但又专业十足。通俗易懂描述临床试验从发现,到筛选,到选择剂量,到适应症,到上市的过程。讲述研究设计的一些浅显概念。尽管书中很多地方所用术语和FDA指南中不一样,但核心思想谈不上有什么错误,可以负责任的说,如果读懂这些,即便这一些内容错误,也足够让你很专业。
欢迎阅读“了解临床试验”手册 - 帮助您了解临床试验及其分析的关键概念和术语的资源。本指南专对于癌症,但其中解释的概念和术语可应用于其他疾病领域。
在实验室确定的每5,000个关于癌症的分子中,将有约250个进入临床前试验。在这250个分子中,只有不超过10个会进入临床试验中进行仔细的检测,平均只有一个会被监管部门批准。从研究阶段(实验室)到诊疗机构应用新治疗过程阶段估计需要10-13年。
新药开始于实验室中,研究人员对成千上万有潜力治疗癌的分子,进行的鉴定,隔离和研究。
一旦在实验室中鉴定出候选分子(化合物),就会对其进行严格的临床前测试(在实验室和/或动物中)以评估其化学,生物学和毒理学性质(其有多么有害)。(译者注:在原始化合物库中,使用某些手段对化合物最终成药可能性做评估,并进行排序,接着按照序列,使用临床前试验手段对化合物再次做评估,然后进入临床阶段这是纵向;在横向方向上会对化合物的药效、药代、毒理、合成费用和创新性上进行探索;这其中的每一个节点都是一门学科!)
如果临床前研究的结果是肯定的,那么该化合物能进入临床试验计划:这涉及几个“阶段”的研究,通常从健康志愿者的小型研究开始,逐步进行到在病人中评估药物。在每个阶段,只有符合严格的安全性和有效性标准的化合物才能进入下一阶段。
当临床试验根据结果得出所研究的化合物安全有效时,公司向管理部门申请销售许可(销售许可,并在日常医疗实践中使用该药)。这种情况通常发生在成功的III期研究之后,但是可能会发生在就没有治疗选择的疾病中,有时被描述为“高度医疗需求”。
最后,如果上市许可被批准,医生则可依规定提供新的治疗方法。关于给予治疗的许可有严格的规定 - 制药公司的产品只能推广用来医治许可证或说明书里面描述的疾病(适应症)。
临床试验探讨了一种治疗方法在人体内的反应,旨在确保药物在获得监督管理的机构许可之前可以耐受且有效,并可供医生使用。研究的主要目标或终点(即试验最重要的结果),参与的患者人数以及研究设计的详细情况各不相同。然而,所有的临床研究需要符合一套严格的标准来保护患者,确保对药物进行严格的评估。

临床试验设计与许多参数有关,以使产生的结果有意义。这些参数包括待研究的患者群体,待研究的治疗,终点和做试验的方法(例如随机与非随机)。
如果患者被纳入试验,则一定要符合特定标准。常见的进入标准包括:具有某种类型的癌症,具有特定的治疗史,并处于特定的年龄组。入选标准有助于确保试验人群尽可能相似(就基本概况,疾病类型和阶段而言),从而尽可能将产生的任何治疗效果的结果与正在研究的治疗药物联系起来而不是其他因素。
在对照试验中——大多数III期试验和一些II期试验属于这一类——将正在研究的药物或方案与对照作比较。对照可以是被称为安慰剂的医学上无效的治疗(如果对正在研究的疾病没有有效的治疗方法),也可以是标准治疗- 在试验设计时被普遍的使用和认为有效。尽管安慰剂有时在临床试验中被用作对照,但在癌症试验中很少使用安慰剂,这种方法有几率存在道德问题。有必要注意一下的是,由于一些临床试验需要数月甚至数年的时间才能完成,因此在试验结果报告的时候,标准治疗可能不再被广泛使用。
临床试验的目的是测量关键结果或终点,并测试特定疾病治疗方法的临床疗效和耐受性。试验通常会指定一个主要终点。这是该试验最重要的终点,若符合,则意味着试验和治疗的积极结果。
临床试验方案为研究行为提供了设计,并预先列出了研究的终点。以及关于如何以及何时测量和评估研究终点有明确的指导。
主要终点通常评估治疗效果(干预或药物重现预期效果的能力)。试验也可以定义一个或多个次要终点。这些通常包括次要功效测量(设计用于评估药物在控制疾病中的临床有效性的额外评估)和安全终点(设计用于测量在研究期间的治疗的耐受性和安全性)。
当试验人群,治疗和终点被确定和定义时,试验设计还没完成。在III期和一些II期临床试验中,患者人群可以随机分配(随机分配接受一种或另一种正在研究的替代治疗方法)并分层(除了治疗以外的其他因素进行分层,通常要确保相同的数字 具有影响预后或干预反应特征的参与者将分配给每个对照组)。临床研究的黄金标准是科学严谨,随机,对照良好的试验。
在确诊后确定的一段时间内存活的患者百分比,或者在治疗研究中,在治疗开始后的确定时间存活的患者百分比。OS通常被报告为五年存活率,即在诊断或治疗五年后存活的患者的百分比。诊断不同疾病后报告的OS率可能不一样,因为一些癌症的前景(存活率)比其他人好。治疗对OS的影响应该相对于给定癌症的背景或预期的OS来看待。
然而,在评估早期治疗方案时,测量OS可能是有问题的(治疗方案是患者经历的一系列治疗方法,例如一线方案是用于靶向肿瘤的初始治疗方案,一线方案不起作用接下来是二线方案治疗)。这是因为OS的测量经常受到后期治疗方法的影响,使得难以确定一线治疗对OS的真实效果。
例如,PFS-6是在治疗开始后六个月,在没有疾病恶化的情况下接受治疗的患者的比例或比例。
疾病进展通常是有症状和不舒服的,所以推迟疾病进展对患者是非常有意义的,并且是医生和护士的重要目标。
如果药物变得无效,患病的人能转换到另一种疗法(交叉)或采取额外的治疗。与其他一些终点(例如OS)不同,PFS不受这种交叉疗法或随后的治疗方式的影响(后一种治疗方法通常与前一种治疗方法不同),因为它只适用于疾病恶化。
生活品质(QoL)临床试验可以评估治疗对患者的幸福感和日常生活能力的影响。这些都是使用生活质量工具(问卷和量表)来衡量的,这些工具已经被开发用于评估特定癌症诊断受一定的影响的生活品质的特定方面。
现在一些试验包括患者报告的结果(PRO)作为衡量生活品质的方法之一。这些措施对患者特别的重要,因为这些措施显示了治疗对日常生活的影响。
缓解疾病进展速率测量肿瘤的大小,通常使用扫描或X射线。它表明肿瘤是否对治疗有反应 - 如果肿瘤大小缩小,则认为已经有“反应”。有不同的方法来确定缓解率,国际上认可的RECIST(实体瘤疗效评价标准)指南经常用于临床试验。
所有疾病的临床证据消失。这通常意味着使用医学成像技术(扫描仪/放射学测试)和/或通过对病理样本和样本(组织,活组织检查,血液等)等的测量手段检验测试发现肿瘤消失。
所有可检测肿瘤的大小减少30%或25%。这些“减少”或“增加”被认为是“稳定的疾病”的原因是因为没有治疗,可能预期许多现有的肿瘤会继续增长或扩散,而不是减小或上涨的速度低于预期。
进行性疾病(PD)自既往测量以来,患者或肿瘤大小增加≥25%的患者比例。不同于CR,PR或SD,PD表明癌症正在前进,而不是减轻或稳定。
治疗后癌症缩小(部分缓解- PR)和/或消失(完全缓解--CR)的患者百分比。
在某些癌症类型中,ORR尤其重要,特别是那些引起损伤性损伤的癌症。基底细胞癌,其中能够正常的使用广泛的手术来去除损伤。
在一定时间内癌症缩小或保持稳定的患者的百分比。DCR是疾病完全,部分和稳定的总和。
确诊部分缓解(PR),完全缓解(CR)或稳定疾病(SD)的时间,直至治疗后疾病进展(疾病进展或PD)。
衡量患有癌症诊断的患者在治疗之前,期间或之后是否能在日常生活中执行日常工作的程度。具体的数字PS量表指示疾病引起的残疾水平,和/或症状的严重程度。两个主要的标准是:东部肿瘤协作组(ECOG)将患者的表现状态定义为从零到五,其中零是完全活跃的,五是死的。如果一个人只能有限的自我照顾,或者被限制在睡觉或睡觉的时间超过50%的清醒时间,那么他就是三。
从100%(无症状)到0%(死亡)评估癌症相关症状和残疾程度的严重程度。50%的评价表明,患者需要大量的帮助和频繁的医疗护理。
预计癌症治疗可能会影响PS评分 - 如果疾病负担降低,或治疗副作用影响患者执行普通任务的能力,则积极治疗。
TTP是从随机化到肿瘤进展的时间,不包括死亡。这与从随机化到肿瘤进展或死亡的时间PFS不同。
治疗后的时间长度,患者在疾病最初治疗的部位(即没再次出现新转移的时间- 身体不一样的部位没有疾病迹象 - 一种疾病从一个器官或一部分传播身体到另一个不相邻的器官或部分。)
在辅助治疗之后,患者居住(或幸存)的时间而没有侵袭性疾病的复发(除了主要的治疗形式,例如除了手术之外还给予化疗的治疗,旨在通过摧毁可能的剩余癌症来延迟或预防复发性疾病细胞)。
治疗期间或之后留在患者体内的残留恶性细胞的存在。这是白血病等癌症复发的主要原因。
PK是研究药物进入人体后发生了什么。特别是一段时间内血液中药物的浓度。当试验比较相同的分子时,主要使用药代动力学终点,并试图确定药物靶向的主要医疗条件最有效的剂量。
Ctrough是给定给药间隔期间的最小血清药物浓度。就剂量而言,当药物达到Ctrough水平时,这表明何时需要下一剂药物 - 因此从给药到Ctrough的时间与给定药物的给药频率相关。
桥接研究测试药物在不同亚组患者或药物递送方法中的药代动力学是否有差异。例如,桥接研究可拿来比较体重指数(BMI)差异很大的人群,以确定是不是应该按体重调整剂量。
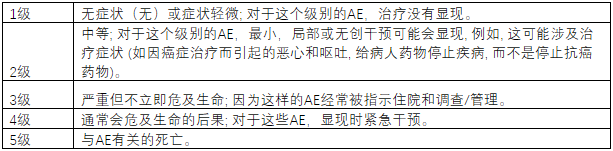
当治疗被描述为安全时,并不代表不存在与其使用相关的潜在风险,只是认为治疗对患者的好处被认为超过了潜在的风险。AE是任何不利的,意外的症状,迹象(例如异常的实验室发现)或与使用治疗相关的疾病。AE能够准确的通过其严重程度进行分级:
了解关键的统计概念在研究的对照组和治疗组中,达到给定终点的平均患者数量只能说明治疗效果。重要的是要确定治疗组之间的差异有没有统计学显着性(差异反映的是模式而不仅仅是机会),因此能为患者带来真正的益处。
统计分析测量和评估来自研究的数据,以试图提供治疗有效性的可靠测量,治疗之间的差异显示某些事件(疾病的体征,症状或因素)的风险的相关变化的可能性并给出在数学上精确测量治疗的有效性与益处。
临床试验结果的正确解释取决于适当和准确的统计分析,并理解它们在数字和患者方面的含义。
组间差异的数学测度; 如果在一个治疗组中观察到的值(例如达到CR的人数)与另一个治疗组相比的差异大于单独偶然发生的情况,那么认为其具有统计学意义。
p值是偶然获得统计结果的可能性,假定被调查的治疗之间没有差异。p值越低,结果发生机会的可能性越小,结果可能更多地归因于被测试的药物。
被认为是显着的p值可以变化,但通常设定为0.05。p值为0.05意味着结果偶然发生的可能性只有5% - 因此,结果是由于治疗效果的真实差异而不是单独的机会。
P值是观察到的差异偶然发生的概率。小于0.05的p值表示统计显着性,即事件偶然发生的概率小于5%
是一组数字中的中间值,当它们从小到大排列时,例如5,7,9,10,13,18,23的中位数为10.在临床试验中,当50%的患者经历事件(例如死亡或复发)时达到中位数。通常用一个小的“m”来表示终点的中间数字,例如mPFS(中位无进展生存期)。重要的是要记住,以中位数值存活可能并不总是能提供最准确的治疗效果图。例如,如果51%的患者获得的治疗时间仅为2个月或更少,而49%的患者获得10个月或更长的时间,那么中位生存时间实际上可以计算为不到两个月,这并非是真实的反映的好处。同样,如果一个试验例如有800个病人,一旦达到400个终点,就会达到中位数(例如,经历了一个特定事件)。但其他400可能会做得更好,而中值不会反映这一点。
另一种平均—算术平均--通常在医学之外使用, 但很少用于临床试验, 因为病人的疾病表现方式有很大的差异。
算术平均值是通过加和一组数字(例如, 一组结果) 并除以数字的个数来计算的平均数。5,7, 9,10,13,18,23的平均是12.1。
风险比是一个试验组相对于另一个试验组在整个试验期间发生的事件(例如疾病进展)的相对风险。
1的HR意味着组间没有差异,2的HR意味着有两倍的风险,而HR 0.5意味着有一半的风险。
在下面的例子中,OS为0.73的HR表示与药物B相比,用药物A治疗组的进展或死亡风险降低27%。其计算如下:-1-0.73(HR) x 100 = 27%的风险降低。
重要的是,与中位数不同,危险比考虑了整个试验期间事件的差异,而不是在试验的特定时间点或试验结束时的事件差异,因此更好地预测了治疗的实际效果在整个患者人群中。该方法具有使用所有可用信息的优点,包括因任何原因未完成试验的患者。因此,当描述端点事件的风险相对于时间不恒定时,HR是最有用的。
HR经过测量整个试验中每个手臂的Kaplan-Meier曲线之间的差异或空间来确定治疗效果
CI百分比表示结果将落入由指定的较低和较高“置信界限”,例如,95%可信区间为0.65(较低) - 0.80(上限)的HR结果意味着有95%的确定性,在相同的研究条件下,相同人群的HR结果将在0.65和0.80之间。这个范围如何窄或宽能够给大家提供关于结果精度的有价值的信息。狭窄的CI意味着高精度,宽的CI意味着低精度。
ARR是在治疗组中发生事件的次数(例如,已发展的患者的百分比)与对照组中发生事件的次数之间的绝对差异。例如,在一项研究中,用药物A治疗的患者中有10%进展,用药物B治疗的患者中有15%进展,与药物B相比,药物A的疾病进展有5%的ARR:ARR = 15%-10% = 5%。
RRR看待不同治疗组患者之间的相同差异,但将风险的变化表示为一个比例,而不是绝对的差异。使用上面的例子,进展RRR与药物B相比降低了33%:RRR =(15-10)/ 15 = 5/15 = 33.3%。
NNT是一个统计数据,能告诉患者实际需要接受特定治疗(或联合治疗)的患者数量,从而获得特定的终点获益。NNT是根据临床研究数据计算出来的,被认为是决定治疗是否有益于大量患者或只是少数患者给药的有用措施。NNT越低,治疗越有效。
治疗有效性的一个量度,OR是治疗组发生事件的几率,以对照组发生事件的几率的比例表示。OR越接近1,治疗干预和对照干预的效果差异就越小。如果OR大于(或小于)1,则治疗的效果比对照治疗的更大(或更小)。
统计学方法允许对研究中的所有数据来进行分析并随时间进行全方位检查,以发现简单中位数测量(在试验中的特定点处进行的测量)无法说明的治疗之间是不是存在统计学显着性差异。使用正确的统计工具,可以对治疗效果做准确测量,并考虑患者开始治疗时间的不同开始时间和长度。
KM曲线表示在连续时间仍然存活(或没有疾病或某些其他特定结果或终点)的研究人群的比例。
这是表示总体生存或疗效的最常用的方法。治疗研究中的KM曲线显示总体存活率,曲线提供了一段时间的图表。他们将接受调查药物的患者与对照组患者作比较,显示在一段时间内仍然存活的患者的百分比。它根据患者接受治疗的时间来计算这个百分比,而不是当他们进入研究时。
曲线的分离越大,所分析的端点中处理组之间的差别越大。如果KM曲线中所示的治疗组遵循相似的路径,则表明在被测量的终点中研究的组之间仅有少量差异。如果双组相遇,那就从另一方面代表着在那个特定的时间点,在被测量的终点的研究的两个组之间没有区别。
此处显示的KM曲线是假设的,并不意味着实际数据。此处显示的KM曲线是假设的,并不意味着实际数据。
在一项研究中,有一些研究对一种治疗进行了研究,或者一项研究中的患者亚组可能对治疗有不同的反应,森林图(FP)是显示和比较不同组数据的一种方式。
FP是一种有用的方法,可以一目了然地观察一种治疗方法的好处或效果在整个研究中还是在不同亚组的患者中是一致的。数据集例如小组或研究通常显示为正方形。正方形的大小与该数据集的大小或重要性(重要性)成正比,并且每个框的任一侧的水平线表示置信区间。
该图显示了在一个特定的一组患者中,相对于另一种治疗,治疗是否提供了积极的结果,使用两列和表示治疗没有效果的划分的垂直线来显示。通常情况下,垂直线左侧的数据表明干预治疗比对照更有效,而落在无效(垂直)线右侧的数据表明,在该亚组或研究中,比较是比干预更有效。
在下面的例子中(见图9),对一个研究中不同患者亚组的PFS风险比进行了说明。在落在垂直线左侧的患者亚组中,治疗A比治疗B更有效。然而,垂直线右侧的亚组意味着在那些患者亚组中,治疗B比治疗A更有效。
这种类型的图表分别反映每个患者,例如查看每位患者肿瘤的缓解率状况,无论是进展,稳定还是改善。在癌症研究中,瀑布图通常用于说明ORR数据。
研究的阶段表明药物或治疗在开发道路上有多远。例如,一大批病人的III期研究只能在早期调查的最终结果令人鼓舞的情况下进行,通常会被用来支持执照申请。
主要终点是试验最重要的终点,通常用于评估疗效。了解终点与癌症类型的相关性及其对患者意味着什么对于了解任何研究的重要性非常重要。
了解研究比较组的重要性将有利于解释研究的重要性。例如,将调查治疗与标准治疗作比较的研究比将调查治疗与疾病背景或安慰剂中未批准的治疗相比更为重要。
通常,参与研究的患者越多,结果就越显着。由于结果是从大量患者中获得的,因此减少了某些不寻常的患者对整体统计数据的反应的影响,因此结果更准确地反映了治疗将怎么样影响调查之外的一般患者人群。
p值有助于证明研究结果是偶然的可能性,而不是被测试的治疗之间的差异。小于0.05的p值是显着的,并且显示偶然发生结果的可能性低于5%。
术语表包括癌症临床试验出版物中的常用术语,包括期刊中的临床论文,新数据的国会报告以及宣布试验结果的新闻稿。
了解这些术语,特别是涉及试验设计的术语,能够在一定程度上帮助解释临床试验结果及其与癌症患者的相关性。
除了治疗的主要形式(例如除了手术之外的化学疗法)之外还给予治疗,其旨在通过破坏可能的剩余癌细胞来延迟或预防复发性疾病。
在一个设盲的临床试验中,患者不明白他们是否正在接受有活性的药物或其他治疗/安慰剂。当患者和研究者都不明白他们被分配到哪个组时,该研究是双盲的。设盲的试验是为了尽可能的避免偏见。
给予患者对照治疗(即安慰剂或目前接受的标准护理治疗)的随机试验的“组”(或患者组)。为了测定治疗效果,将治疗组(患者给予所研究的新药/药物的患者)的反应与对照组中观察到的反应进行比较。
终点在临床开始试验之前被设定和定义,终点描述并定义研究的目标。终点的例子(根据试验的类型和阶段而变化)包括总生存期,毒性,肿瘤反应,患者生存期或生活质量。
治疗的“线”描述了治疗癌症的顺序。一线治疗是用于靶向肿瘤的最初治疗。一线治疗无效或不再使用时,给予二线治疗。
负责审查临床试验的小组确保他们符合道德标准,并且去参加了的患者得到适当的保护。
临床研究的描述性术语,其中医疗保健提供者和患者都知道已经分配了什么治疗,即该研究是不盲的。
临床研究成为向监管部门申请批准药物的基础。通常是大小合适的III期,随机,双盲对照试验。
一个临床研究的描述性术语,其中一组患者接受非活性物质或安慰剂,而被评估的药物则给予另一组:设计用于比较药物与“不”治疗的功效。安慰剂对照试验很少用于癌症治疗,新的治疗方法更可能与现有的标准治疗方案相比较。
在“现实世界”背景下进行的研究收集癌症数据,以及不同癌症治疗的效果,这些癌症治疗来自正在就诊并由自己的医生或医院接受治疗的患者群体(与临床试验相比,患者是专门招募参加研究与一个非常规定的一套规则)。
监管部门审查和评估临床研究数据,并负责确保新药在被批准用于患者之前对其预期用途是安全和有效的。如果提交成功,监管当局将授予上市许可(允许出售药物)。监管部门的例子包括美国的食品与药物管理局(FDA)和欧洲的欧洲药品管理局(EMA)。
分层是将患者分组的一种方法,当可能会影响干预成功的因素已知时,用于随机试验中。例如,癌症从原始肿瘤部位扩散的参与者可以与没有扩散的癌症分开或分层,因为有可能预期这些患者分别具有更晚期和更晚期的疾病,并且可能对治疗有不同的反应干预措施。
4:欧洲制药工业联合会(EFPIA)。高度规范的行业。访问时间:2012年11月。网址:?PageID = 361:
5:实体瘤的疗效评估标准(RECIST)。RECIST。访问2012年11月。可在:
6:东欧肿瘤协作组(ECOG)。ECOG简介。访问2012年11月。可在:

